Le cachalot est le plus grand des cétacés à dents. Bien qu’il ait la taille de la plupart des grandes baleines à fanons, il possède des dents sur la mâchoire inférieure et les utilise pour saisir les gros calmars ou les poissons, contrairement aux autres grandes baleines qui filtrent à travers leurs fanons des proies plus petites et plus denses. Animal quasi mythique, le cachalot a été historiquement craint et vénéré dans les cultures du monde entier. Le célèbre roman du XIXe siècle, Moby Dick, met en scène un cachalot et s’inspire des expériences des « baleiniers yankees » qui, dans les années 1800, parcouraient les océans du monde entier pour chasser les baleines à bord de petits bateaux ouverts. Bien qu’il ne soit pas la plus grande des baleines, il possède la plus grande tête et le plus gros cerveau de tous les animaux de la planète, peut plonger plus profond que presque tous les autres mammifères marins et vit dans une société matrilinéaire stable et complexe semblable à celle des éléphants. Les cachalots se rencontrent généralement dans les eaux profondes de haute mer, mais ils peuvent être observés plus près des côtes, autour des îles ainsi que dans des zones où des canyons sous-marins ou un étroit plateau continental offrent un habitat littoral en eau profonde.
Partager cette page!
X

Risques de confusion
Le cachalot est facile à identifier de loin grâce à son souffle unique, qui se projette vers l’avant et légèrement vers la gauche (toutefois, les observateurs doivent savoir que le vent peut également faire pencher le souffle d’autres espèces dans un sens ou un autre). Bien que la petite bosse de sa nageoire dorsale puisse ressembler à celle d’une baleine grise ou d’une baleine à bosse, le cachalot est facile à distinguer de près grâce à sa tête carrée et sa peau ridée.
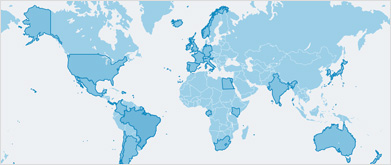
Répartition
Les cachalots se rencontrent dans les eaux profondes de haute mer, ou autour des îles et des zones côtières présentant des canyons profonds ou des plateaux continentaux très étroits. Seuls les mâles ont tendance à être observés plus près des pôles au-delà d’environ 40° S ou 40° N1,2.
Présence, y compris de manière saisonnière, du cachalot dans les pays et territoires suivants : Afrique du Sud ; Albanie ; Algérie ; Angola ; Antarctique ; Antigua-et-Barbuda ; Argentine ; Australie ; Bahamas ; Bangladesh ; Barbade ; Belgique ; Belize ; Bénin ; Bonaire, Saint-Eustache et Saba ; Brésil ; Brunei Darussalam ; Cabo Verde ; Cameroun ; Canada ; Chili ; Chine ; Chypre ; Colombie ; Comores ; Corée (République de) ; Corée (République populaire démocratique de) ; Costa Rica ; Croatie ; Curaçao ; Danemark ; Djibouti ; Dominique ; Égypte ; El Salvador ; Équateur ; Espagne ; États-Unis d’Amérique ; Fidji ; France ; Gabon ; Gambie ; Ghana ; Gibraltar ; Grèce ; Grenade ; Groenland ; Guatemala ; Guinée ; Guinée équatoriale ; Guinée-Bissau ; Guyana ; Haïti ; Honduras ; Îles Féroé ; Îles Malouines (Falkland/Malvinas) ; Îles Marshall ; Îles Salomon ; Inde ; Indonésie ; Iran (République islamique d’) ; Irlande ; Islande ; Israël ; Italie ; Jamaïque ; Japon ; Kenya ; Kiribati ; Liban ; Libéria ; Libye ; Madagascar ; Malaisie ; Maldives ; Malte ; Maroc ; Maurice ; Mauritanie ; Mexique ; Micronésie(États fédérés de) ; Monaco ; Mozambique ; Namibie ; Nauru ; Nicaragua ; Nigéria ; Nioué ; Norvège ; Nouvelle-Zélande ; Oman ; Pakistan ; Palaos ; Panama ; Papouasie–Nouvelle-Guinée ; Pays-Bas ; Pérou ; Philippines ; Portugal ; Fédération de Russie ; République arabe syrienne ; République dominicaine ; Royaume-Uni de Grande-Bretagne et d’Irlande du Nord ; Sainte-Hélène, Ascension et Tristan da Cunha ; Sainte-Lucie ; Saint-Kitts-et-Nevis ; Saint-Martin ; Saint-Vincent-et-les-Grenadines ; Samoa ; Sao Tomé-et-Principe ; Sénégal ; Seychelles ; Sierra Leone ; Singapour ; Slovénie ; Somalie ; Sri Lanka ; Suriname ; Taiwan (Province de Chine) ; Tanzanie (République-Unie de) ; Thaïlande ; Timor-Leste ; Togo ; Tonga ; Trinité-et-Tobago ; Tunisie ; Turquie ; Tuvalu ; Uruguay ; Vanuatu ; Venezuela (République bolivarienne du) ; Viet Nam ; Yémen.
Biologie et écologie
Régime alimentaire
Les cachalots se nourrissent généralement en profondeur. Diverses espèces de calamars, dont le calmar géant, Architeuthis, constituent leurs proies. Les femelles se nourrissent presque exclusivement de calmars, tandis que les mâles peuvent s’attaquer à des poissons de fond, notamment des requins, des raies, des morues et des merlus1. Les cachalots plongent régulièrement à une profondeur moyenne de 800 mètres pendant 50 minutes pour rechercher leur nourriture. Leur corps est particulièrement adapté à cette plongée profonde, avec des caractéristiques telles que de fortes concentrations de myoglobine, une protéine transportant l’oxygène, dans leurs muscles,3 et une cage thoracique repliable qui permet de comprimer leurs poumons pendant les plongées profondes.
Structure sociale, reproduction et croissance
Les cachalots forment des groupes sociaux très stables autour de femelles apparentées et de leur progéniture. Ces groupes ont tendance à vivre dans des zones océaniques de haute mer, et ont occasionnellement la visite de mâles qui se déplacent largement à travers les océans. Les petits naissent après une période de gestation de 14 à 16 mois et restent avec leur mère pendant de nombreuses années. Le jeune commence à manger des aliments solides vers l’âge d’un an, mais peut continuer à téter pendant plusieurs années encore, jusqu’à la naissance du petit suivant. Les jeunes mâles quittent leur unité familiale féminine entre 4 et 21 ans et rejoignent souvent un « groupe de célibataires » composé d’autres mâles du même âge et de la même taille. Ces groupes de célibataires sont observés dans les eaux plus froides vers les pôles. Les jeunes femelles, quant à elles, restent avec leur unité familiale de 4 à 21 individus et aident à prendre soin des jeunes du groupe jusqu’à ce qu’elles soient assez matures pour donner naissance à leur propre petit. Comme l’orque, il s’agit de l’une des rares espèces de mammifères autres que l’humain, chez qui les femelles continuent à vivre et à jouer un rôle dans les groupes familiaux/sociaux après avoir cessé de se reproduire. Les mâles pleinement matures reviennent dans les eaux plus chaudes où se trouvent les femelles pour s’accoupler, ne passant parfois que quelques minutes ou quelques heures avec un groupe avant de repartir1,4.
Recherche, menaces et état de conservation
Les cachalots peuvent être reconnus individuellement au cours du temps grâce aux crénelures et aux cicatrices sur leur aileron dorsal et leur nageoire caudale. Ces photos sont utilisées pour suivre les déplacements des individus au cours du temps, estimer la taille de la population locale et comprendre la structure sociale et la dynamique de population des groupes étudiés5-7.
L’échantillonnage génétique et l’utilisation de balises pour suivre le comportement de plongée des baleines ont été très importants pour la compréhension du comportement et des populations de cachalots 8-10. Plus d’informations sur les techniques de recherche utilisées pour étudier les cétacés sont disponibles ici.
Prédateurs naturels
Des orques ont été observées en train d’attaquer des groupes de cachalots, et les grands requins sont également considérés comme des prédateurs potentiels des baleineaux. Dans certaines régions du monde, les cachalots réagissent de manière coordonnée aux attaques en se rassemblant en une formation de type « marguerite » ou « roue de chariot », dans laquelle tous les membres du groupe se positionnent avec la tête au centre et la queue tournée vers l’extérieur, comme les rayons d’une roue. Ils se défendent ensuite en balançant leur queue d’avant en arrière. Parfois, un baleineau vulnérable ou un individu blessé se trouve au centre de la formation 1,11.
Menaces d’origine humaine
Les cachalots sont aujourd’hui confrontés à un certain nombre de menaces, notamment l’enchevêtrement dans les engins de pêche12-14, l’ingestion d’engins de pêche et de débris marins 15,16, et les collisions avec des navires17-22. Ce dernier facteur est considéré comme l’une des principales causes du déclin des populations de cachalots en Méditerranée18,20,21, et comme une menace majeure pour la survie de l’espèce aux îles Canaries 17,19.
État de conservation
Les cachalots ont historiquement fait l’objet d’une chasse intensive et l’espèce est aujourd’hui classée dans la catégorie Vulnérable sur la Liste rouge des espèces menacées de l’UICN2. La sous-population méditerranéenne, génétiquement distincte, est considérée comme En danger, car elle est estimée à moins de 2500 individus, et les menaces de collisions avec des navires et d’enchevêtrement persistent dans toute la zone23. Le cachalot est inscrit à l’Annexe I de la Convention sur les espèces migratrices (CMS).
Cachalot et tourisme d’observation
En raison de leur présence principalement au large des côtes, il n’existe que quelques endroits dans le monde où les cachalots peuvent être régulièrement observés et constituer le point central du tourisme d’observation des baleines. Ces lieux comprennent : Kaikura (Nouvelle-Zélande), où des fjords profonds offrent un bon habitat pour les cachalots près du rivage24, et où plusieurs études analysent les effets possibles à court et à long terme du tourisme d’observation sur les baleines 25,26 ; les Açores (Portugal) et les îles Canaries (Espagne), où l’on s’inquiète également de la pérennité de l’observation des baleines et de la pression du trafic maritime27. Pour le cachalot, comme pour toutes les autres espèces, il est important que des lignes directrices soient appliquées pour limiter les conséquences des activités d’observation sur le bien-être et la survie à long terme de ces animaux.
Références
Afficher / Masquer les références
- Whitehead, H., Sperm Whale, Physeter macrocephalus, in Encyclopedia of Marine Mammals, W. Perrin, B. Wursig, and J.G.M. Thewissen, Editors. 2009, Elsevier: San Francisco. p. 1091-1097.
- Taylor, B.L., et al., Physeter macrocephalus in IUCN Red List of Threatened Species. 2008, http://www.iucnredlist.org/details/41755/0 Downloaded on 9 October 2017.
- Mirceta, S., et al., Evolution of Mammalian Diving Capacity Traced by Myoglobin Net Surface Charge. Science, 2013. 340(6138).
- Whitehead, H., The behaviour of mature male sperm whales on the Galapagos breeding grounds. Can J Zool, 1993. 71.
- Childerhouse, S. and S.M. Dawson, Stability of fluke marks in individual photoidentification of male sperm whales at Kaikoura, New Zealand. 1996. p. 447-451.
- Frantzis, A., P. Alexiadou, and K.C. Gkikopoulou, Sperm whale occurrence, site fidelity and population structure along the Hellenic Trench (Greece, Mediterranean Sea). Aquatic Conservation: Marine and Freshwater Ecosystems, 2014. 24(S1): p. 83-102.
- Gero, S. and H. Whitehead, Critical Decline of the Eastern Caribbean Sperm Whale Population. PLoS ONE, 2016. 11(10): p. e0162019.
- Engelhaupt, D., et al., Female philopatry in coastal basins and male dispersion across the North Atlantic in a highly mobile marine species, the sperm whale (Physeter macrocephalus). Molecular Ecology, 2009. 18(20): p. 4193-4205.
- Whitehead, H., Gene–culture coevolution in whales and dolphins. Proceedings of the National Academy of Sciences, 2017. 114(30): p. 7814-7821.
- Watkins, W.A., et al., Sperm whale dives tracked by radio tag telemetry. Marine Mammal Science, 2002. 18(1): p. 55-68.
- Ponnampalam, L., No Danger in Sight? An Observation of Sperm Whales (Physeter macrocephalus) in Marguerite Formation off Muscat, Sultanate of Oman. Aquatic Mammals, 2016. 42(2): p. 162-167.
- Di Natale, A. and G. Notarbartolo-di-Seiara, A review of the passive fishing nets and trap fisheries in the Mediterranean Sea and of the cetacean bycatch. 1994. p. 189-202.
- García-Godos, I., et al., Entanglements of large cetaceans in Peru: few records but high risk. Pacific Science, 2013. 67(4): p. 523-532.
- Haase, B. and F. Felix, A note on the incidental mortality of sperm whales (Physeter macrocephalus) in Ecuador, in Gillnets and Cetaceans, W.F. Perrin, G. Donovan, P., and J. Barlow, Editors. 1994, Report of the International Whaling Commission: Cambridge, U.K. p. 481-484.
- de Stephanis, R., et al., As main meal for sperm whales: Plastics debris. Marine Pollution Bulletin, 2013. 69: p. 206–214.
- Jacobsen, J.K., L. Massey, and F. Gulland, Fatal ingestion of floating net debris by two sperm whales (Physeter macrocephalus). Marine Pollution Bulletin, 2010. 60: p. 765–767.
- Carrillo, M. and F. Ritter, Increasing numbers of ship strikes in the Canary Islands: proposals for immediate action to reduce risk of vesselwhale collisions. Journal of Cetacean Research and Management, 2010. 11(2): p. 131–138.
- De Stephanis, R. and E. Urquiola, Collisions between ships and cetaceans in Spain. Document presented to the Scientific Committee of the International Whaling Commission SC/58/BC5, 2006.
- Fais, A., et al., Abundance and Distribution of Sperm Whales in the Canary Islands: Can Sperm Whales in the Archipelago Sustain the Current Level of Ship-Strike Mortalities? PLoS ONE, 2016. 11(3): p. e0150660.
- Frantzis, A., et al., Update on sperm whale ship strike risk in the Hellenic Trench, Greece. Report presented to the Scientific Committee, of the International Whaling Commission 2015. SC/66a/HIM06(Sand Diego, California): p. 6.
- Rendell, L. and A. Frantzis, Mediterranean Sperm Whales, Physeter macrocephalus: The Precarious State of a Lost Tribe, in Advances in Marine Biology. 2016, Academic Press.
- Laist, D.W., et al., Collisions between ships and whales. Marine Mammal Science, 2001. 17(1): p. 35-75.
- Notabartolo di Sciara, G., et al., Physeter macrocephalus (Mediterranean subpopulation), in IUCN Red List of Threatened Species. 2012, http://www.iucnredlist.org/details/16370739/0 Downloaded on 9 October 2017.
- Dawson, S.M., Distribution, abundance and population structure of Sperm Whales at Kaikoura 1996, WWF. p. 2-32.
- Gordon, J., et al., Effects of whale-watching vessels on the surface and underwater acoustic behaviour of sperm whales off Kaikoura, New Zealand, in Science & Research Series No. 52. 1992, Department of Conservation: Wellington, New Zealand.
- Richter, C., S. Dawson, and E. Slooten, Impacts of commercial whale watching on male sperm whales at Kaikoura, New Zealand. Marine Mammal Science, 2006. 22(1): p. 46-63.
- Ritter, F., Abundance, distribution and behaviour of cetaceans off La Gomera (Canary Islands) and their interaction with whale-watching boats and swimmers, in Master's Thesis. University of Bremen. Bremen, Germany. 1996.