Le rorqual à museau pointu (ou petit rorqual boréal) et le rorqual de l’Antarctique (ou rorqual à museau pointu de l’Antarctique) sont des petits rorquals largement répandus dans les régions tropicales, tempérées et polaires. Étant les plus petits et les plus profilés des rorquals, ils sont faits pour la vitesse. Le nom scientifique acutorostrata fait référence à la forme pointue et aérodynamique de la tête du rorqual à museau pointu. Il existe deux espèces reconnues de petits rorquals dont les aires de répartition se chevauchent partiellement : le rorqual à museau pointu (Balaenoptera acutorostrata), et le rorqual de l’Antarctique (B. bonaerensis)1. Le rorqual à museau pointu nain est une sous-espèce du rorqual à museau pointu qui se rencontre presque exclusivement dans l’hémisphère Sud. En outre, les rorquals à museau pointu de l’Atlantique Nord et du Pacifique Nord sont également considérés comme des sous-espèces distinctes. Ces rorquals ne sont pas connus pour leurs comportements acrobatiques ou curieux autour des navires, mais leur répartition large et principalement côtière en fait l’une des cibles des activités d’observation des baleines dans le monde entier.
Partager cette page!
X

Risques de confusion
De loin, les petits rorquals peuvent être confondus avec d’autres rorquals comme le rorqual commun, le rorqual boréal ou le rorqual de Bryde. Mais lorsqu’on les observe de près, leur petite taille, leur aileron dorsal plus haut et placé plus près de la tête, ainsi que la bande blanche caractéristique sur les nageoires pectorales les rendent faciles à identifier.
Répartition
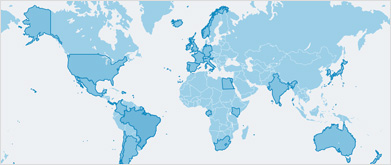
Les rorquals à museau pointu et de l’Antarctique sont largement présents dans la plupart des régions tropicales, tempérées et polaires2 depuis environ 65° S jusqu’à 80° N3. Le rorqual à museau pointu se rencontre dans tous les bassins océaniques, la sous-espèce rorqual à museau pointu nain étant plus ou moins limitée à l’hémisphère Sud. Les rorquals de l’Antarctique se rencontrent généralement à des latitudes comprises entre 60° S et la bordure de la banquise, bien qu’ils puissent également être présents à l’intérieur des zones de banquise, ce qui les rend difficiles à étudier4.
Présence du rorqual à museau pointu dans les pays et territoires suivants : Afrique du Sud ; Anguilla ; Antarctique ; Antigua-et-Barbuda ; Argentine ; Australie ; Bahamas ; Bangladesh ; Belgique ; Bermudes ; Bonaire, Saint-Eustache et Saba (Saba, Saint-Eustache) ; Brésil ; Canada ; Cabo Verde ; Chili ; Chine ; Corée (République de) ; Corée (République populaire démocratique de) ; Cuba ; Curaçao ; Danemark ; Dominique ; Équateur ; Espagne ; États-Unis d’Amérique ; Fédération de Russie ; France ; Gambie ; Grèce ; Groenland ; Guadeloupe ; Guyane française ; Îles Féroé ; Îles Turques-et-Caïques ; Îles Vierges américaines ; Îles Vierges britanniques ; Islande ; Indonésie ; Irlande ; Israël ; Italie ; Japon ; Maroc ; Mauritanie ; Mexique ; Mozambique ; Nouvelle-Calédonie ; Nouvelle-Zélande ; Norvège ; Papouasie–Nouvelle-Guinée ; Pays-Bas ; Porto Rico ; Portugal ; Saint-Martin (partie française) ; Saint-Martin (partie néerlandaise, Sint Maarten) ; Saint-Pierre-et-Miquelon ; Sénégal ; Svalbard et Jan Mayen ; Suède ; Taiwan (Province de Chine) ; Thaïlande ; Tunisie ; République dominicaine ; Royaume-Uni de Grande-Bretagne et d’Irlande du Nord ; Uruguay ; Sahara occidental.
Présence du rorqual de l’Antarctique dans les pays et territoires suivants : Afrique du Sud ; Antarctique ; Argentine ; Australie ; Brésil ; Chili ; Géorgie du Sud et îles Sandwich du Sud ; Namibie ; Nouvelle-Zélande ; Pérou ; Terres australes françaises ; Uruguay.
Biologie et écologie
Régime alimentaire
Le rorqual à museau pointu a un régime alimentaire varié, de nombreuses populations se nourrissant dans les bancs de divers petits poissons allant de l’anchois au maquereau, au hareng, au capelan et à la morue. Certaines populations sont également connues pour leur consommation de plancton, et le krill est une proie importante pour les rorquals à museau pointu au large du Groenland. Le rorqual de l’Antarctique se nourrit presque exclusivement de krill – comme de nombreuses autres espèces de baleines boréales qui s’alimentent dans les eaux de l’Antarctique2.
Structure sociale, reproduction et croissance
Les déplacements saisonniers du rorqual à museau pointu et du rorqual de l’Antarctique sont moins prévisibles et moins bien définis que ceux de nombreuses autres espèces de baleines à fanons qui présentent un schéma de migration saisonnière très clair entre les zones d’alimentation estivales et les zones de reproduction hivernales. Bien que certaines populations puissent faire des déplacements saisonniers, la reproduction peut avoir lieu toute l’année, et les baleineaux naissent environ 10 mois après la conception. Les jeunes restent avec leur mère pendant 5 à 6 mois. Les femelles atteignent l’âge de la reproduction à 7-8 ans et semblent pouvoir donner naissance à un baleineau chaque année, contrairement à de nombreuses autres baleines à fanons qui ne produisent qu’un baleineau tous les 2 à 3 ans2,5.
Menaces et état de conservation
Prédateurs naturels
L’orque est le seul prédateur naturel connu des rorquals à museau pointu et des rorquals de l’Antarctique. En Antarctique, les petits rorquals pourraient même constituer une composante majeure du régime alimentaire de certaines formes d’orques2.
Menaces d’origine humaine
Comme la plupart des espèces de baleines et de dauphins, les rorquals à museau pointu et les rorquals de l’Antarctique peuvent s’enchevêtrer dans les engins de pêche6,7. Les prises accessoires de petits rorquals semblent particulièrement élevées au large des côtes japonaises et coréennes3. Une autre menace potentielle est la bioaccumulation de contaminants tels que les organochlorés et le DDT dans les graisses de ces deux espèces8-10
État de conservation
Considérés comme trop petits et trop rapides pour être chassés, le rorqual à museau pointu et le rorqual de l’Antarctique ont été négligés par l’ensemble des baleiniers tout au long des XIXe et XXe siècles, et n’ont fait l’objet d’une chasse intensive que lorsque la plupart des autres espèces ont été gravement épuisées et difficiles à localiser. Ainsi, leurs populations ont généralement été moins gravement touchées par la chasse que celles d’autres espèces2. Aujourd’hui, ils sont toutefois parmi les rares espèces de baleines à être encore chassées en grand nombre dans les pays qui ont fait objection au moratoire actuel de la CBI sur la chasse à la baleine, comme l’Islande et la Norvège, ainsi que par le Japon qui mène des programmes de chasse scientifique dans l’Antarctique et le Pacifique Nord.
En raison de sa répartition diffuse, le rorqual à museau pointu est difficile à évaluer au niveau mondial. Cependant, il est classé dans la catégorie Préoccupation mineure sur la Liste rouge de l’UICN des espèces menacées, principalement parce qu’il a été moins touché par la chasse commerciale que les autres espèces de baleines à fanons. Certaines populations font l’objet de chasses annuelles jugées durables par les pays qui les pratiquent (Islande, Norvège et Japon). Les sous-espèces de l’Atlantique Nord oriental ainsi que du Pacifique Nord oriental sont inscrites à l’Annexe II de la CMS.
Le rorqual de l’Antarctique est classé dans la catégorie Données insuffisantes sur la Liste rouge de l’UICN. Actuellement, l’espèce semble compter plus de 500 000 individus3,15. Des analyses ont révélé que son effectif a augmenté de 1930 jusqu’au milieu des années 1970, qu’il a diminué entre le milieu des années 1970 et environ 1988, puis qu’il est resté plus ou moins stable au cours des 20 dernières années11,6. Toutefois, l’abondance estimée pendant les saisons d’été 1991/92 - 2003/04 dans l’hémisphère Sud était environ 30 % inférieure à celle estimée pendant les saisons d’été 1985/86-1990/9115,3 Les raisons de cette situation n’ont pas été entièrement expliquées. Le rorqual de l’Antarctique figure à l’Annexe II de la Convention sur les espèces migratrices (CMS).
Rorquals à museau pointu et de l’Antarctique et tourisme d’observation
Les rorquals à museau pointu sont l’une des principales cibles des activités côtières d’observation des baleines menées en bateau en Écosse12, en Norvège et en Islande13, mais leur habitat chevauche souvent celui des baleines à bosse qui ont tendance à éclipser leurs cousins plus petits et moins visibles. Ils sont également présents en Colombie-Britannique, au Canada14, où ils partagent la vedette avec les orques, les baleines à bosse et les baleines grises. Les rorquals à museau pointu nains sont cependant le centre du spectacle dans un programme unique de nage avec les baleines qui opère depuis plus de 20 ans sur la Grande Barrière de Corail, en Australie.15
Des études ont montré que les bateaux (d’excursion pour l’observation des baleines) peuvent détourner les rorquals à museau pointu et les rorquals de l’Antarctique d’importantes possibilités d’alimentation13. Et comme pour toutes les autres espèces, la gestion responsable du nombre de bateaux/excursions, le respect des distances et méthodes d’approche autorisées par des réglementations claires ainsi que le contrôle du respect de ces réglementations sont de la plus haute importance non seulement pour profiter de ces animaux, mais aussi pour s’assurer qu’ils restent en sécurité et en bonne santé.
Références
Afficher / Masquer les références
- Committee on Taxonomy. List of marine mammal species and subspecies. Society for Marine Mammalogy, www.marinemammalscience.org, consulted on 11 october 2017. (2017).
- Perrin, W. F. & Brownell Jr, R. L. Minke whales Balaenoptera acutorostrata and B. bonaerensis in Encyclopedia of Marine Mammals (eds W. Perrin, B. Wursig, & J.G.M. Thewissen) 733-735 (Elsevier, 2009).
- Reilly, S. B. et al. Balaenoptera acutorostrata in I IUCN Red List of Threatened Species (http://www.iucnredlist.org/det... Downloaded on 9 October 2017, 2008).
- Williams, R. et al. Counting whales in a challenging, changing environment. Scientific reports 4 (2014).
- Jefferson, T. A., Webber, M. A. & Pitman, R. L. Marine Mammals of the World: a Comprehensive Guide to their Identification. Second Edition. (San Diego: Academic Press, 2015).
- Knowlton, A. R. et al. Effects of fishing rope strength on the severity of large whale entanglements. Conservation Biology, n/a-n/a, doi:10.1111/cobi.12590 (2015).
- Van Waerebeek, K. et al. Spatial and temporal distribution of the minke whale, Balaenoptera acutorostrata (Lacécepède, 1804), in the southern northeast Atlantic Ocean and the Mediterranean Sea, with reference to stock identity. Journal of Cetacean Research and Management 1, 223-237 (1999).
- Aono, S., Tanabe, S., Fujise, Y., Kato, H. & Tatsukawa, R. Persistent organochlorines in minke whale (Balaenoptera acutorostrata) and their prey species from the Antarctic and the North Pacific. Environmental Pollution 98, 81-89, doi:https://doi.org/10.1016/S0269-... (1997).
- Kleivane, L. & Skaare, J. U. Organochlorine contaminants in northeast Atlantic minke whales (Balaenoptera acutorostrata). Environmental Pollution 101, 231-239, doi:https://doi.org/10.1016/S0269-... (1998).
- Moon, H.-B. et al. Chlorinated and brominated contaminants including PCBs and PBDEs in minke whales and common dolphins from Korean coastal waters. Journal of Hazardous Materials 179, 735-741, doi:https://doi.org/10.1016/j.jhaz... (2010).
- Punt, A. E., Bando, T., Hakamada, T. & Kishiro, T. Assessment of Antarctic minke whales using Statistical Catch-at-age Analysis. Journal of Cetacean Research and Management 14, 93-116 (2014).
- Parsons, E. From whaling to whale watching: a history of cetaceans in Scotland. Glasgow Naturalist 25, 53-57 (2012).
- Christiansen, F., Rasmussen, M. & Lusseau, D. Whale watching disrupts feeding activities of minke whales on a feeding ground. Marine Ecology Progress Series 478, 239-251 (2013).
- Williams, R. & Thomas, L. Distribution and abundance of marine mammals in the coastal waters of British Columbia, Canada. Journal of Cetacean Research and Management 9, 15-28 (2007).
- Birtles, R., Arnold, P. & Dunstan, A. Commercial swim programs with dwarf minke whales on the northern Great Barrier Reef, Australia: some characteristics of the encounters with management implications. Australian Mammalogy 24, 23-38 (2002).